C'est vrai, il existe un certain nombre de métaux indésirables (ou clochards) (Cu, Sn, Sb, As) qui pénètrent dans le flux de recyclage, par exemple, des carrosseries de voitures broyées sans enlever tous les câbles en cuivre ou l'étain -cans en acier revêtu. L'antimoine et l'arsenic ont tendance à s'infiltrer à partir de sources de fer primaire de faible qualité et peu coûteuses.
La réponse à la question est non. L'acier recyclé est mélangé aussi uniformément que possible à partir de sources variées, sa composition est mesurée, puis du fer pur est ajouté selon les besoins pour diluer les métaux résiduels à des niveaux tolérables pour la revente ou un traitement ultérieur, tel que le respect d'une nuance d'acier spécifique pour un produit spécifique ou application. Les aciers inoxydables et autres nuances fortement alliées connues au moment du recyclage sont traités séparément en raison de la valeur du Ni, du Cr, etc.
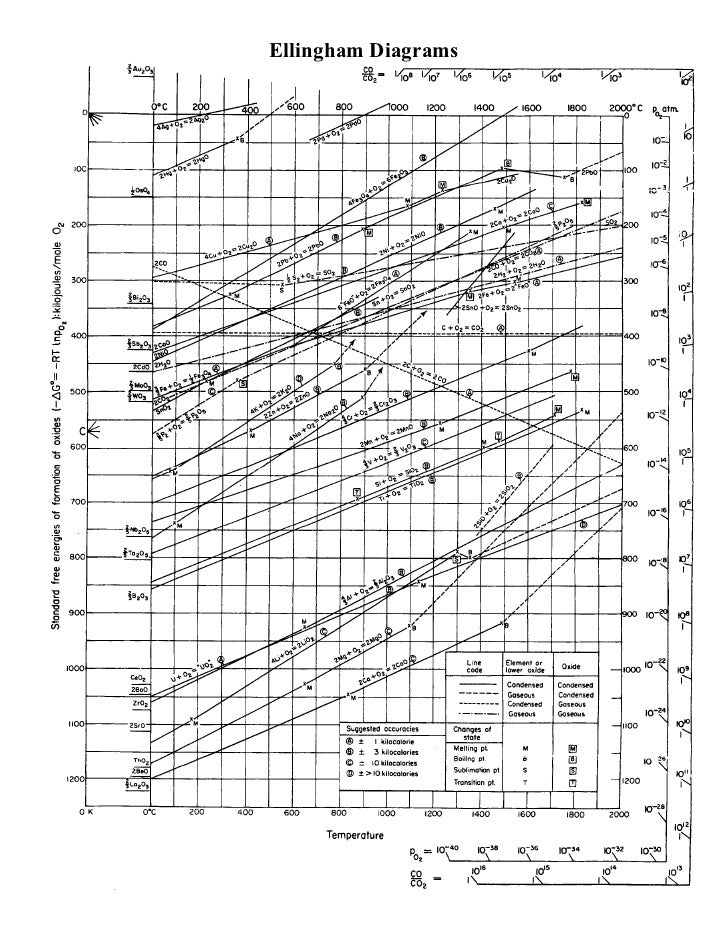
Il n'est actuellement pas rentable de retraiter le fer pour éliminer les éléments parasites, et cela ne se fait donc pas du tout. Deux livres mentionnent le processus comme un processus régulier et économique: ( Minéraux, métaux et durabilité: répondre aux besoins futurs en matériaux , p. 284, à partir de la «dilution») et ( Production d'acier: procédés, produits et résidus), à partir de la p. 104, lisez jusqu'à ce qu'il ne soit plus pertinent). La raison pour laquelle il n'est pas économique est que les éléments vagabonds réagissent plus faiblement avec l'oxygène que le fer à température constante, donc pour les éliminer par oxydation, il faudrait d'abord oxyder tout le fer. La raison en est thermodynamique et repose sur le fait que parmi les réactions concurrentes, celles qui ont les plus fortes diminutions d'énergie libre se poursuivent pratiquement avant la fin des autres réactions, même en commençant, en particulier avec de grandes différences d'énergie libre entre les réactions concurrentes. Pour déterminer quelles réactions ont les plus fortes diminutions, un diagramme d'Ellingham peut être utilisé.
Dans le diagramme d'Ellingham ci-dessous, l'axe horizontal est la température, l'axe vertical est le changement d'énergie libre de Gibbs. Les lignes traversant le diagramme sous différents angles correspondent au changement d'énergie libre provoqué par les réactions d'oxydation des éléments avec l'oxygène, en fonction de la température. Dans notre cas, le diagramme peut être lu en choisissant une température d'intérêt, et en lisant du bas pour trouver le premier élément à réagir avec l'oxygène. Par exemple, si nous avons de l'acier contenant du Fe, du Mn, du Sn et du Cu, nous pouvons voir qu'à 1000 K, Mn, Fe (à FeO), Sn et Cu sont de l'ordre de la plus grande à la plus petite baisse d'énergie libre.
Certes, la température d'intérêt est plus proche de 1900K (au-dessus du point de fusion du fer), mais les tendances générales de chaque fonction de changement d'énergie libre de Gibbs continuent vers la droite sur le diagramme et le fer reste en dessous des éléments clochards Cu, Sn, As et Sb aux températures pratiques, et probablement à leurs points d'ébullition respectifs. En conséquence, l'élimination des débris de Fe nécessiterait d'oxyder efficacement tout le fer en premier. Et parce que Sn, Sb, As et Cu sont légèrement solubles dans le fer, ils nécessitent une séparation par réaction chimique.
On peut voir la solubilité des clochards à partir de leurs diagrammes de phases avec le fer, dont j'ai posté Sb-Fe ci-dessous. Le diagramme présente la température par rapport à la composition, chaque région 2D contiguë étant composée d'une phase ou d'un mélange des deux phases à gauche et à droite, qui sont en équilibre à cette combinaison de température et de composition. En bas à gauche, nous voyons que pour de petites quantités de Sb et de température ambiante, il existe une région contiguë qui dans ce cas désigne une seule phase, ou alpha-Fe (le type que nous connaissons). Parce qu'il y a du Sb et qu'il est en une seule phase, il doit être dissous dans le fer. Il en va de même, avec une gravité variable, des autres clochards.

(source: himikatus.ru )
Comme l'a fait remarquer Chris H, la question se pose également de savoir quand les autres éléments d'alliage sont contrôlés. En général, l'addition d'alliage est contrôlée aussi près que possible de la solidification, afin de minimiser la perte d'alliage.
Les déchets sont fondus en vrac dans un four à arc électrique. Si le flux de ferraille est suffisamment mélangé, la concentration de déchets peut être estimée sur la base de l'utilisation passée et le fer primaire est ajouté avant l'analyse chimique pour compenser l'estimation. La masse est ensuite fondue, l'oxygène est éliminé via l'ajout d'éléments au bas du diagramme d'Ellingham, spécifiquement Ca et Al, et le métal fondu est transféré dans une ou plusieurs poches hautement isolées. Le Ca et l'Al réagissent rapidement avec l'oxygène dissous dans la masse fondue pour créer des scories d'oxyde de faible densité qui flottent et sont éliminées mécaniquement. La chimie est prise après ce processus, et si les clochards sont suffisamment dilués, le métal est transféré dans des poches. Sinon, une quantité suffisante de fer primaire est ajoutée pour diluer la masse fondue.
Une fois dans la poche, des éléments d'alliage supplémentaires sont ajoutés. Ils ne sont pas ajoutés plus tôt en raison du diagramme d'Ellingham: la plupart des éléments d'alliage, y compris Mn, Mo, Cr, V, C, etc. ont une plus grande perte d'énergie libre que Fe, et réagissent donc en premier. En d'autres termes, ils s'estompent. Pour éviter la décoloration par addition d'alliages coûteux, ils sont ajoutés le plus près possible du processus de solidification. De plus, en éliminant d'abord l'oxygène en utilisant Al et Ca, il y a moins d'oxygène dissous dans le fer pour réagir avec les éléments d'alliage les plus chers. Une fois dans la poche, il y a très peu de turbulence d'interface liquide-atmosphère, donc la diffusion de nouvel oxygène dans le fer liquide est relativement lente. Il y a bien sûr encore une limite de temps, et tenir une louche trop longtemps entraînera la décoloration de l'alliage. Après l'addition de l'alliage, la chimie est vérifiée, puis la poche est versée.
Modifié pour ajouter des sources. Modifié pour ajouter une discussion sur le contrôle des alliages.

